【www.easydail.com--中考化学】
化学元素周期表[1]是根据原子序数从小至大排序的化学元素列表。列表大体呈长方形,某些元素周期中留有空格,使特性相近的元素归在同一族中,如卤素、碱金属元素、稀有气体(惰性气体或贵族气体)、放射性元素等。下面是五度学习网www.wudu001.com分享的元素周期表。供大家参考!元素周期表
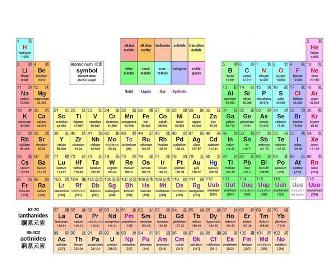
现代化学的元素周期律是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,他将当时已知的63种元素依相对原子质量大小并以表的形式排列,把有相似化学性质的元素放在同一列,制成元素周期表的雏形。经过多年修订后才成为当代的周期表。在周期表中,元素是以元素的原子序排列,最小的排行最先。表中一横行称为一个周期,一列称为一个族。
原子半径由左到右依次减小,上到下依次增大。
在化学教科书和字典中,都附有一张“元素周期表(英文:the periodic table)”。这张表揭示了物质世界的秘密,把一些看来似乎互不相关的元素统一起来,组成了一个完整的自然体系。它的发明,是近代化学史上的一个创举,对于促进化学的发展,起了巨大的作用。看到这张表,人们便会想到它的最早发明者——门捷列夫。1869年,俄国化学家门捷列夫按照相对原子质量由小到大排列,将化学性质相似的元素放在同一纵行,编制出第一张元素周期表。元素周期表揭示了化学元素之间的内在联系,使其构成了一个完整的体系,成为化学发展史上的重要里程碑之一。随着科学的发展,元素周期表中未知元素留下的空位先后被填满。当原子结构的奥秘被发现时,编排依据由相对原子质量改为原子的质子数﹙核外电子数或核电荷数﹚,形成现行的元素周期表。
按照元素在周期表中的顺序给元素编号,得到原子序数。原子序数跟元素的原子结构有如下关系:
质子数=原子序数=核外电子数=核电荷数
利用周期表,门捷列夫成功的预测当时尚未发现的元素的特性(镓、钪、锗)。1913年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序)排列。后来又经过多名科学家多年的修订才形成当代的周期表。
元素周期表中共有118种元素。将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵列。每一种元素都有一个序号,大小恰好等于该元素原子的核内质子数,这个序号称为原子序数。在周期表中,元素是以元素的原子序排列,最小的排行最前。表中一横行称为一个周期,一列称为一个族(8、9、10纵行为一个族)。
原子的核外电子排布和性质有明显的规律性,科学家们是按原子序数递增排列,将电子层数相同的元素放在同一行,将最外层电子数相同的元素放在同一列。
元素周期表有7个周期,16个族。每一个横行叫作一个周期,每一个纵行叫作一个族。这7个周期又可分成短周期(1、2、3)、长周期(4、5、6)和不完全周期(7)。共有16个族,又分为7个主族(ⅠAⅡA ⅢA ⅣA ⅤA ⅥA ⅦA), 7个副族(ⅠB ⅡB ⅢB ⅣB ⅤB ⅥB ⅦB),一个第Ⅷ族(包括三个纵行),一个零族。
元素在周期表中的位置不仅反映了元素的原子结构,也显示了元素性质的递变规律和元素之间的内在联系。使其构成了一个完整的体系称为化学发展的重要里程碑之一。
同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)。
同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子序数递增,元素金属性递增,非金属性递减。
元素周期表的意义重大,科学家正是用此来寻找新型元素及化合物。
2015年12月30日,国际纯粹与应用化学联合会(IUPAC)宣布俄罗斯和美国的研究团队已获得充分的证据,证明其发现了115、117和 118号元素。此外,该联合会已认可日本理化学研究所的科研人员发现了113号元素。两个研究团队通过让质量较轻的核子相互撞击,并跟踪其后产生的放射性超重元素的衰变情况,合成了上述四种元素。
俄罗斯杜布纳联合原子核研究所与美国加利福尼亚劳伦斯利弗莫尔国家实验室的研究人员,已被确认发现了115、117和118号元素。在2004 年和2007年展开实验后,他们还声称发现了113号元素。
IUPAC执行理事林恩·瑟比说,有关确认新元素的报告将于2016年初公布。官方对这些元素的认可意味着它们的发现者有权为其命名并设计符号。113号元素将成为首个由亚洲研究人员发现并命名的元素。
ⅠA1ⅡA2ⅢB
3ⅣB4Ⅴ B
5ⅥB6ⅦB7Ⅷ
8 9 10ⅠB11ⅡB12ⅢA
13ⅣA14ⅤA
15ⅥA
16ⅦA17018
H
氢 He
氦
Li
锂Be
铍 B
硼C
碳N
氮O
氧F
氟Ne
氖
Na
钠Mg
镁 Al
铝Si
硅P
磷S
硫Cl
氯Ar
氩
K
钾Ca
钙Sc
钪Ti
钛V
钒Cr
铬Mn
锰Fe
铁Co
钴Ni
镍Cu
铜Zn
锌Ga
镓Ge
锗As
砷Se
硒Br
溴Kr
氪
Rb
铷Sr
锶Y
钇Zr
锆Nb
铌Mo
钼Tc
锝Ru
钌Rh
铑Pd
钯Ag
银Cd
镉In
铟Sn
锡Sb
锑Te
碲I
碘Xe
氙
Cs
铯Ba
钡镧系Hf
铪Ta
钽W
钨Re
铼Os
锇Ir
铱Pt
铂Au
金Hg
汞Tl
铊Pb
铅Bi
铋Po
钋At
砹Rn
氡
Fr
钫Ra
镭锕系Rf
鈩DbSgBhHsMt
䥑Ds
鐽Rg
錀Cn
鎶UutFl
鈇UupLv
鉝UusUuo
镧系La
镧Ce
铈Pr
镨Nd
钕Pm
钷Sm
钐Eu
铕Gd
钆Tb
铽Dy
镝Ho
钬Er
铒Tm
铥Yb
镱Lu
镥
锕系Ac
锕Th
钍Pa
镤U
铀Np
镎Pu
钚Am
镅Cm
锔Bk
锫Cf
锎Es
锿Fm
镄Md
钔No
锘Lr
铹
"Uut、Fl、Uup、Lv、Uus、Uuo"中Uut、Uup、Uus、Uuo至今(2014年11月)仍未被IUPAC认可,所以无其中文名称;Fl、Lv在一些化学元素周期表中无中文名称。
更多相关内容:-
就业推荐表导师评语
会议通知表
会议记录表范文
excel考勤表下载
员工入职登记表
行政单位资产负债表

 网站地图
网站地图